今回のテーマは「潜熱」と「顕熱」についてです。
恐らく物理学に興味のある人や、理系出身の方であれば聞いたことある人は多いのではないでしょうか?
何となく難しそうな感じで、いきなり登場すると敬遠する人は多いと思います。

高校の物理でも習った気がするけど、一体どんな意味何だっけ?

何となく「熱」に関係する概念なのはわかるけど、2つは何がどう違うの?

そもそも読み方がわからないよ。
漢字もやや難しいなので、その原理や定義の違いも難しく、理解しづらい印象ですね。
しかし実は2つの熱は、とても身近に登場することがわかりました。
ということで今回は両者の定義の違いと、気象など身近に用いられている例も合わせてわかりやすく解説していきます!
スポンサーリンク
潜熱と顕熱の定義の違い!
さて結論からになりますが、潜熱と顕熱の定義をそれぞれ一言で簡単に説明しましょう。
- 潜熱:温度は変わらずに物質の状態が変わる時の熱
- 顕熱:物質の状態が変わらずに温度が変わる時の熱
このようになります。
また難しい漢字ですが、読み方についてはそれぞれ
- 潜熱は「せんねつ」
- 顕熱は「けんねつ」
となります。
温度が変わらない時の熱が潜熱、温度が変わる時の熱が顕熱ということなんですね。
だけどこう言われても、ピンと来ない人も多いでしょう。

温度が上がったり下がれば熱が移動するのはわかるけど、温度が変わらなくても熱が移動するってどういうこと?
このような疑問を抱く人も少なくないです。
物理学における熱の基本的な概念も含めて、次の項から深く掘り下げていきますね。
「潜熱」とは何か?
改めて潜熱についての定義をおさらいしますと、物体の温度が変わらない状態で移動する熱を指します。
では「温度が変わらなくても熱が移動する」時の状態って、一体どういう時なんでしょうか?
これについては、水を使ってわかりやすく解説していきます。
水道の蛇口をひねると、液体の水が出てきます。コップに入れても、液体の状態は変わりませんね。
だけど冷凍庫に入れて冷凍させると、冷えて固まっていき氷になります。
そしてやかんに入れて沸騰させると、ブクブクと泡を立てて沸騰し、水蒸気になっていきます。

この2つの現象について、それぞれ以下のように水の状態変化が起きています。
- 水→氷:「液体→固体」
- 水→水蒸気:「液体→気体」
また理科の実験を思い出してほしいのですが、それぞれの状態変化が起きる時の温度は0℃と100℃でしたね。
この2つの温度はそれぞれ融点と沸点と呼びます。
そして重要なのが、これらの温度時に状態が変化しても、温度計の目盛りは変化しないことです。
0℃の時に水は氷に全て変化し、100℃の時に水は水蒸気に全て変化します。
すなわち温度が変化していないということなので、この瞬間に発生する熱こそが潜熱というわけです。

温度が変化していなくても発生するということは、人間の目では確認できないよね。だから「潜んだ熱」と書くんだ。
だけど温度が変わらなくても、熱の移動が必要になる原理はこれでもイマイチつかめないでしょう。
実はこれには物質を構成する分子の間にある力と、熱振動という2つの要素が関係していました。
スポンサーリンク
物質の状態変化

物質を構成する分子は、互いにくっつきあっています。
そしてこのくっつき具合によって、物質が固体か液体か気体のいずれかに分かれるということです。
しかしそれと同時に分子同士は、互いに離れようという性質もあります。
お互いにくっつこうとする力と、離れようとする力の2種類が働いているわけですが、この2種類の力の均衡を崩す要因が熱エネルギーとなります。
もっと詳しく説明しますと、
物質がある一定の温度まで上がると、分子同士でくっつこうとする力よりも、離れようとする力が大きくなって状態変化が起きる
ということになるのです。
世の中にある全ての物体は、一定の気圧下では温度が上がるにつれて
と変化します。
固体の方が液体よりも、分子同士がくっつきやすいので、固まった状態になり、常に決まった位置に分子が配置されているのです。
温度が上がると、固体から液体になり、分子同士が離れやすくなるのですが、それでも互いに手を繋ぎ合っているような状態です。
離れやすくなりましたが、まだくっついている、形も変わりやすくなって凄く中途半端な状態なんですね。
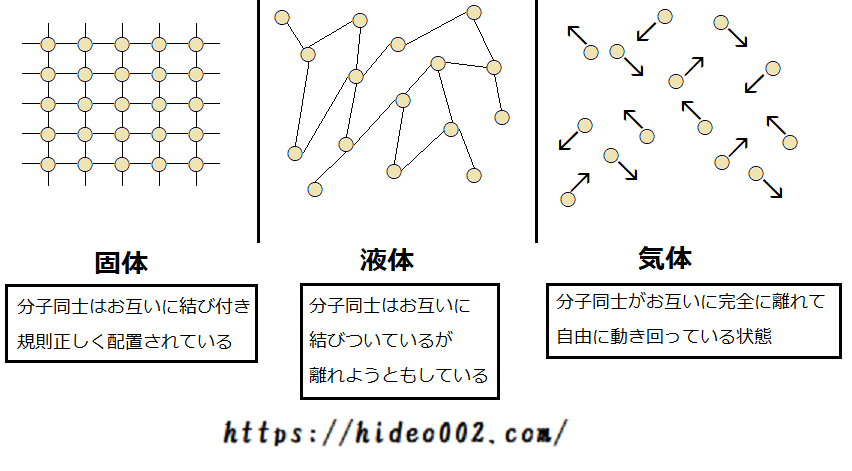
そしてさらに温度が上がると、分子同士が互いに離れ、自由に飛び回る状態になります。
このような状態変化が起きるのは、熱エネルギーを与えることで、分子間で起きている熱振動が加速度的に大きくなることが原因です。
つまり「固体から液体」、「液体から気体」と状態変化を起こすには、それ相応の熱エネルギーが必要になるわけで、その正体が潜熱ということです。
氷を温めた素手で握ったり、お湯に入れると氷はすぐ溶けますが、掴んだ手やお湯は冷めてしまいます。
これは氷が手やお湯から熱を奪って、水に変わった代わりに、手やお湯は熱が奪われて冷たくなった、という2つの変化が起きていると解釈できますね。
またやかんに入れた水も、ガスコンロの炎から熱エネルギーを奪って、そのエネルギーで沸騰し水蒸気に変化する、という見方もできるのです。
潜熱の種類とは?
先ほど「状態変化を起こすには、それ相応の熱エネルギーが必要になる」と説明しましたが、このケースはあくまで「固体から液体」、「液体から気体」と変化する時だけです。
これの逆のパターンは、当然その物質に与える熱エネルギーは不要となります。
すなわち「気体から液体」、「液体から固体」と変化する際は、熱エネルギーを奪うのではなく、熱エネルギーを放出しているのです。
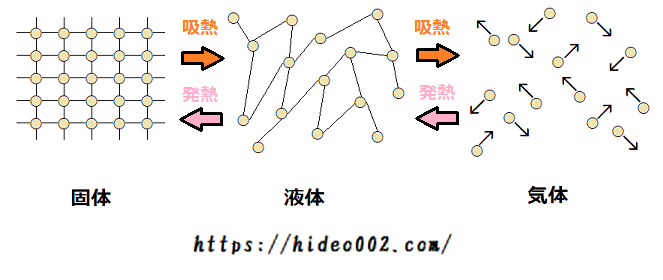
- 固体から液体への変化、液体から気体への変化:吸熱
- 気体から液体への変化、液体から固体への変化:発熱
吸熱が2パターン、発熱が2パターン、合計で4パターンあって潜熱の名称もそれぞれ変わっていきます。
| 変化名 | 潜熱 | |
|---|---|---|
| 固体から液体 | 融解 | 融解熱 |
| 液体から気体 | 蒸発 | 蒸発熱 |
| 気体から液体 | 凝縮 | 凝縮熱 |
| 液体から固体 | 凝固 | 凝固熱 |
またこれらの内で、特に台風のエネルギー源と関係が深いのが凝縮熱です。つまり台風と潜熱は大きく関係していたんですね。
詳しくは以下の記事をどうぞ!
毎年日本には多くの台風が上陸し大きな被害をもたらします。しかしなぜ台風ってあれほどの風速を誇るのでしょうか。台風を生み出す熱のエネルギー源を詳しく紹介していきます。調べてみると、とても身近な物理現象と大きく関係していました。
この数値は後に解説しますが、水の温度を上げた際に必要となる全エネルギー量を計算するのに必要となります。
「顕熱」とは?
顕熱とは、潜熱とは違って温度を上げた(下げた)際に物体間で移動する熱のことです。
因みに「顕」とは漢字一文字で「あらわ」と読んで、意味は「隠れていたものがはっきり見えること」です。
すなわち「顕熱」とは、「その物体に隠れていた熱が表に出てきた熱」ということになります。
温度計で温度を測った時に、目盛りが変化するので、具体的にどのくらい熱エネルギーが発生したかも計算しやすいんですね。
ただその計算時には、もう一つの要素である「熱容量」と「比熱」が登場します。
学校の理科の授業で習う熱容量と比熱は熱力学で必ず出てくる項目です。似たような言葉ですが、改めて両者の違い、さらに比熱の意味と物質ごとの数値について深く掘り下げて解説していきます!
では顕熱がどのくらいの数値になるのか、例として1kgの水の温度を10℃から30℃上げる時を考えましょう。
ここで上げる温度の差分は
ΔT=30-10=20(℃)
求める熱量Qは
Q=1,000×c×ΔT
で求まります、単位はJ(ジュール)です。
ここで登場するアルファベットのcこそ水の比熱で、その定数値は4.18J/g・Kです。
よって上の式に当てはめると、
Q=4.18×1,000×20
=83,600(J)
すなわち、1㎏の水の温度を10℃から30℃まで上げるのに必要な顕熱の量は83,600Jとなります。
このように比較的楽な計算で求まるのが顕熱の特徴です。
※水1kgの重さについては、以下の記事でも紹介しています。
普段の生活で何気なく使う水ですが、1リットルあたりの重さは何kgなのか考えたことありますか。実は調べると意外な事実がわかったのです。また牛乳やガソリンなど水以外の身近なもので1リットルの重さを比較してみました!
「固体→液体→気体」と変化した水の全熱エネルギーを計算!
ではこれまでの内容を踏まえて、マイナス30℃に冷やされた氷が、100℃の気体に熱せられるまでに必要な熱エネルギーを求めてみましょう!
水の質量は全状態において1kg、水の比熱を4.18J/g・K、氷の比熱を2.0J/g・K、融解熱を333.6 kJ/kg、蒸発熱を2,257kJ/kgとします。
水の状態変化を、横軸をエネルギー、縦軸を温度としたグラフで書いてみます。
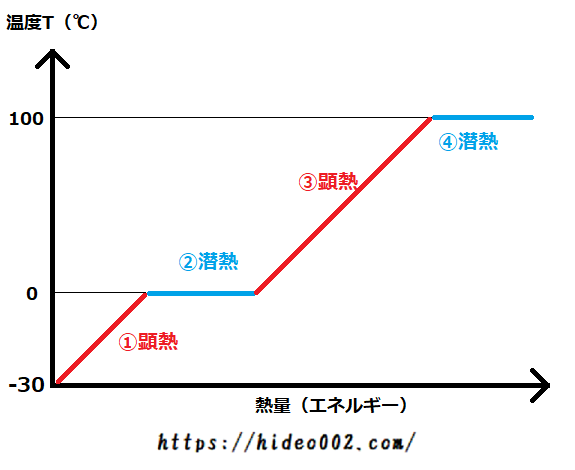
上のような画像になりますが、ここで潜熱変化と顕熱変化の2つを見極めることが大事です。
潜熱は上の画像だと青い線で塗った箇所、顕熱は赤い線で塗った箇所です。
ということで水1kgをマイナス30℃から100度まで加熱するには、
- マイナス30℃→0℃まで:状態は氷で変わらず、顕熱
- 0℃の時:状態が氷から水へ変化、潜熱
- 0℃→100℃まで:状態は水で変わらず、顕熱
- 100℃の時:状態が水から水蒸気へ変化、潜熱
熱量Q1=1,000×2.0×30=60,000J=60kJ
熱量Q2=333.6 kJ
熱量Q3=1,000×4.18×100=418,000J=418kJ
熱量Q4=2,257kJ
よって合計熱量は、全て足し合わせて
60+333.6+418+2,257
=3,068.6(kJ)
となります。
ここで顕熱の熱エネルギーについては、①と③を足し合わせた分だけですが、その分だと約480kJです。
全体の熱エネルギーが約3000kJなので、顕熱はその内の約15%程度に過ぎません。

潜熱と言うのはとても大きな熱エネルギーなんだね!
おまけ:身近にある潜熱と顕熱の例
ここからはおまけの情報となりますが、潜熱と顕熱による熱エネルギーの調整は実はとても身近で起きている現象なのです。
代表的な例をいくつか紹介しましょう!
汗による温度調整

最も身近な例は、実は我々人間の体にありました。
もちろん人間以外の体にも当てはまりますが、暑くなると汗をかきますよね。
体内から水分として出た汗は温度調節の役割を担っているのですが、その原理はやはり潜熱にありました。
周囲の気温が高い時に出る汗は、そのまま蒸発して水蒸気となります。
この時人間の体も相当温度が高くなっているのですが、蒸発する汗が体から温度を吸収して、その熱エネルギーを持って蒸発することになります。
つまり汗をかくことで、体温を維持するという。これによって人間は炎天下でも比較的長い時間、運動ができるのです。
逆にこの機能がないか、もしくは体の一部分にしかない犬や猫などは、炎天下で長時間の運動はできません。
夏場の打ち水

夏の時期に道路に撒く打ち水も、やはり潜熱による効果を狙っています。
炎天下のアスファルトの道路は、信じられないほど温度が上がっています。
その温度が上がった道路に水を撒くことで、やはり人間の汗と同様、蒸発する際に熱エネルギーを奪って温度を下げる、という理屈になります。
エアコンや冷蔵庫も
家電の例で例えますと、エアコンの冷暖房と、冷蔵庫が冷える原理にもやはり潜熱が用いられています。
エアコンがどうして冷えるのか、簡単に解説しますと、室内機と室外機との間にある「冷媒」と言う物質が気化し、その気化した際に室内の温度を下げていることになります。

温度が高い空気に触れることで、冷媒が蒸発し、その空気から熱を奪っているんだね。
暖房の際は、冷媒の流れる向きを逆向きにして、冷房とは反対に暖房として役割を入れ替えているだけです。
因みにこの時用いられる冷媒ガスは、圧縮機と言う機材によって、冷房時は液体として、暖房時は気体として、室内の空気と触れるということになっています。
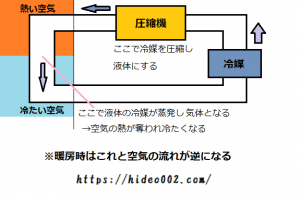
また冷蔵庫についても、やはり蒸発熱によって冷やされるため、エアコンと同様冷媒が使われています。
まとめ
今回は潜熱と顕熱についての解説でした。改めて内容を振り返りましょう!
- 潜熱は温度が変わらない時に発生する熱、顕熱は物質の状態が変わる時の熱
- 物質の分子の結合を引き離すにはより大きな熱エネルギーが必要となる
- 潜熱は融解熱と蒸発熱と凝固熱と凝縮熱の4種類がある
- 顕熱は温度変化で生じる熱エネルギーなので、計算には比熱が必要になる。
- 人間の汗や打ち水、エアコン、冷蔵庫、台風の発生にも関係していた
潜熱と顕熱は難しそうな言葉でしたが、家電や人間の汗にも関係していた現象なのでちょっと驚きですね。
この2つの違いと定義がハッキリすれば、大学での熱力学の講義も頭に入りやすいでしょう。
因みに大学の熱力学ではもう一つエントロピーと言う大事な概念を学ぶことになります。そちらについても記事にまとめていますので、ぜひご覧ください!
熱力学の分野で習うことになるエントロピーの意味を熱力学第二法則を用いて具体的にわかりやすく解説していきます。また統計力学や情報理論でも登場するのでそれぞれの意味についても紹介したいと思います。
スポンサーリンク




